Exercícios sobre gás ideal
O que é um gás?
a) Gás é um fluido que não possui as propriedades de compressibilidade e expansibilidade, portanto ocupa somente uma porção do volume em que está contido.
b) Gás é um líquido cujas moléculas que o constituem estão bastante espaçadas umas das outras.
c) Gás é um fluido que apresenta somente a propriedade de expansibilidade.
d) Gás é um fluido que sofre ação da gravidade e não possui propriedades de compressibilidade.
e) Gás é um fluido que possui as propriedades de compressibilidade e expansibilidade e que tende a ocupar todo o espaço onde está contido.
De acordo com a teoria cinética dos gases, definimos um gás como sendo um fluido que possui as propriedades de compressibilidade e expansibilidade e que tende a ocupar todo o espaço que lhe é oferecido, isto é, ocupa todo o espaço onde está contido.
Alternativa E
Se dois mols de um gás, à temperatura de 27 ºC, ocupam um volume igual a 57,4 litros, qual é, aproximadamente, a pressão desse gás? (Adote R = 0,082 atm.L/mol.K).
a) ≈ 0,76 atm
b) ≈ 0,86 atm
c) ≈ 1,16 atm
d) ≈ 8,16 atm
e) ≈ 0,66 atm
Primeiramente devemos retirar todos os dados fornecidos pelo exercício, para posteriormente resolvê-lo. Sendo assim, temos:
n = 2 mol, V = 57,4 L, T = 27 ºC = 300 K, R = 0,082 atm.L/mol.K, p = ?
Substituindo as informações na equação de Clapeyron, temos:
p.V=n .R .T
p = n .R .T ⟹ p = 2 . 0,082 . 300
V 57,4
p = 0,857 atm ⟹ p ≈ 0,86 atm
Alternativa B
Qual é o volume molar de um gás que está submetido à pressão de 3 atm e à temperatura de 97 ºC?
a) V = 10,1 L
b) V = 1,01 L
c) V = 13,56 L
d) V = 10,99 L
e) V = 11 L
Como o exercício pede o volume molar de um gás, podemos fazer uso da equação de Clapeyron, portanto temos:
n = 1 mol, p = 3 atm, T = 97 ºC = 370 K, R = 0,082 atm.L/mol.K
p.V=n .R .T
V = n .R .T ⟹ p = 1 . 0,082 . 370
P 3
p = 10,1 L
Alternativa A
(Vunesp-SP) À que temperatura se deveria elevar certa quantidade de um gás ideal, inicialmente a 300 K, para que tanto a pressão como o volume se duplicassem?
a) 1200 K
b) 1100 K
c) 900 K
d) 800 K
e) 700 K
À temperatura de 300 K, temos:
To = 300 K, po = p, Vo = V
Para a temperatura que devemos achar, temos:
Tf = ?
pf = 2po
Vf = 2 Vo
Relacionando os valores através da lei Geral dos Gases, temos:
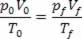
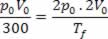
Tf = 300 .4 ⟹ Tf = 1200 K






