Exercícios sobre funções inorgânicas
Faça a associação correta entre as colunas abaixo:
- NaOH, Ca(OH)2, NH4OH ( ) ácidos
- NaCℓ, KNO3, Na2S ( ) bases
- HCℓ, H2SO4, HNO3 ( ) sais
- CO, Al2O3, Pb3O4 ( ) óxidos
(III) ácidos
(I) bases
(II) sais
(IV) óxidos
Sobre os compostos abaixo, responda as questões que seguem:
- H2S
- Na2S
- NH3
- NaOH
- CaCℓ2
- HCℓ
- Ca(OH)2
- Quais são iônicos?
- Quais sofrem ionização e quais sofrem dissociação iônica?
- Para ser iônica, uma substância deve possuir no mínimo um metal. Assim, temos que as substâncias iônicas são: Na2S, NaOH, CaCℓ2 e Ca(OH)2.
- Ionização (ocorre com compostos moleculares, como os ácidos e a amônia): H2S, HCℓ e NH3;
Dissociação iônica (ocorre com compostos iônicos): Na2S, NaOH, CaCℓ2 e Ca(OH)2.
Em condições ambientes, o cloreto de sódio, NaCℓ, é sólido, e o cloreto de hidrogênio, HCℓ, um gás. Ambos não conduzem corrente elétrica nessas condições, mas podem se tornar eletrólitos quando dissolvidos em água. Explique por que isso ocorre.
O cloreto de sódio (sal/ substância iônica) e o cloreto de hidrogênio (ácido/ substância molecular), quando puros, não conduzem corrente elétrica, mas o NaCℓ que quando dissolvido em água sofre dissociação e o HCl quando dissolvido em água sofre sofre ionização, gerando os seguintes íons que conduzem corrente elétrica:
NaCl → Na1+ + Cl1-
HCl → H3O1+ + Cl1- ou HCl → H1+ + Cl1-
(PUC-SP) A respeito das substâncias denominadas ácidos, um estudante anotou as seguintes características:
I) têm poder corrosivo;
II) são capazes de neutralizar bases;
III) são compostos por dois elementos químicos;
IV) formam soluções aquosas condutoras de corrente elétrica.
Ele cometeu erros somente em:
a) I e II
b) I e III
c) I e IV
d) II e III
e) III e IV
Alternativa “b”.
A afirmação I está errada porque nem todo ácido é corrosivo, e a III está incorreta porque existem ácidos com mais de dois elementos, como é o caso do ácido sulfúrico, H2SO4, formado por 3 elementos diferentes.
(Cesgranrio-SP) O ácido clorídrico puro (HCℓ) é um composto que conduz muito mal a eletricidade. A água pura (H2O) é um composto que também conduz muito mal a eletricidade; no entanto, ao dissolvermos o ácido na água, formamos uma solução que conduz muito bem a eletricidade, o que se deve à:
a) dissociação da água em H+ e OH-.
b) ionização do HCℓ, formando H3O+ e Cℓ-.
c) transferência de elétrons da água para o HCℓ.
d) transferência de elétrons do HCℓ para a água.
e) reação de neutralização do H+ da água com o Cℓ- do HCℓ.
Alternativa “b”.
A experiência a seguir é largamente utilizada para diferenciar soluções eletrolíticas de soluções não eletrolíticas. O teste está baseado na condutividade elétrica e tem como consequência o acendimento da lâmpada.
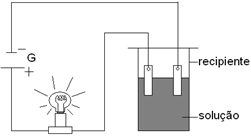
A lâmpada acenderá quando no recipiente estiver presente a seguinte solução:
a) O2(g)
b) H2O(g)
c) HCℓ(aq)
d) C6H12O6(aq)
Alternativa “c”.
Essa é uma solução aquosa de ácido clorídrico, isto é, cloreto de hidrogênio dissolvido em água, liberando os íons a seguir:
HCl → H3O1+ + Cl1- ou HCl → H1+ + Cl1-
Esses íons conduzem corrente elétrica. As demais substâncias são moleculares, sendo que o oxigênio e a água estão no estado gasoso, e a glicose (C6H12O6(aq)) está dissolvida na água, mas não forma íons, ela não pertence a nenhuma função inorgânica, mas é um composto inorgânico.






