Exercícios sobre pontos de ebulição das substâncias
O açúcar comum na verdade é a sacarose, cuja fórmula molecular é C12H22O11 e a sua fórmula estrutural é a mostrada abaixo:
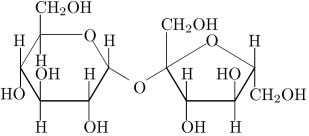
Sobre a sacarose, julgue os itens abaixo como verdadeiros (V) ou falsos (F):
a) ( ) A sacarose é sólida devido à alta massa molecular, pois as forças atrativas entre suas moléculas são muito fracas.
b) ( ) Na fase sólida, as moléculas de açúcar se atraem devido à intensidade das forças de dispersão de London.
c) ( ) A solubilidade do açúcar em água se deve ao estabelecimento de ligações de hidrogênio entre moléculas de sacarose e de água.
a) ( F ) As forças intermoleculares das moléculas de sacarose são as mais intensas, pois são ligações de hidrogênio.
b) ( F ) Como dito no item anterior, as moléculas de açúcar se atraem devido à intensidade das ligações de hidrogênio.
c) ( V )
Analise as temperaturas de ebulição para o grupo de compostos abaixo, justificando-as em termos de interações intermoleculares:
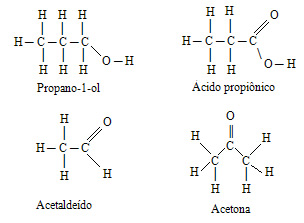
A temperatura de ebulição desses compostos segue a seguinte ordem crescente:
Acetaldeído < acetona < propano-1-ol < ácido propiônico
As duas substâncias de menor temperatura de ebulição são formadas por moléculas polares que não realizam ligações de hidrogênio (essas moléculas estão associadas por ligações do tipo dipolo-dipolo). Como a acetona apresenta uma molécula maior, sua temperatura de ebulição será maior que a do acetaldeído. As duas substâncias de maior temperatura de ebulição apresentam ligações de hidrogênio (interações intensas). Como no ácido propiônico há mais pontos em que é possível ocorrer essas ligações, esse ácido possui temperatura de ebulição elevada.
(Vunesp-SP)O gráfico a seguir foi construído com dados dos hidretos dos elementos do grupo 16.
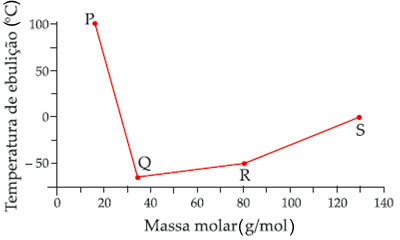
Com base neste gráfico, são feitas as afirmações seguintes.
I) Os pontos P, Q, R e S no gráfico correspondem aos compostos H2Te, H2S, H2Se e H2O, respectivamente.
II) Todos estes hidretos são gases a temperatura ambiente, exceto a água, que é líquida.
III) Quando a água ferve, as ligações covalentes se rompem antes das intermoleculares.
Das três afirmações apresentadas:
a) apenas I é verdadeira.
b) apenas I e II são verdadeiras.
c) apenas II é verdadeira.
d) apenas I e III são verdadeiras.
e) apenas III é verdadeira.
Alternativa “c”.
I. Errado. Os pontos P, Q, R e S no gráfico correspondem aos compostos H2O, H2S, H2Se e H2Te, respectivamente. Isso ocorre porque os hidretos da família 16 são moléculas polares, sendo que a temperatura de ebulição se eleva com o aumento da massa molar. No entanto, a água foge a essa regra, tendo o maior ponto de ebulição entre essas moléculas, porque sua força de atração intermolecular (ligação de hidrogênio) é mais intensa que as das demais (forças dipolo-dipolo).
II. Correto.
III. Errado. Quando a água ferve, as interações intermoleculares se rompem antes das ligações covalentes.
(Unifor-CE) Dentre os elementos abaixo, o que deve apresentar menor temperatura de ebulição sobre pressão ambiente é o:
a) Sódio
b) Ferro
c) Oxigênio
d) Bromo
e) Iodo
Alternativa “c”.
O oxigênio (O2), o bromo (Br2) e o iodo (I2) são substâncias covalentes apolares. Logo, possuem temperaturas de ebulição menores que as do sódio (Na) e ferro (Fe), que são metais. Além disso, das três substâncias (O2, Br2 e I2), é o O2 que tem a molécula mais “leve” e, portanto, a menor temperatura de ebulição.






