Exercícios sobre Propriedades Coligativas
Os médicos aconselham às mães a dar soro caseiro para os filhos quando estes estão com diarreia ou vômito, pois isso faz com que o organismo das crianças perca muita água. Para fazer soro caseiro, a mãe mistura, em um litro de água fervida, uma colher de chá de açúcar e meia colher de chá de sal.
a) Por que é importante seguir exatamente essas medidas?
b) Que propriedade coligativa está relacionada com esse processo?
a) Com a diarreia ou vômito ocorre perda de água e sais minerais pelo organismo. A função do soro caseiro, por via oral, é a de reposição desses elementos perdidos. A criança irá absorver certa quantidade de líquido, que, juntamente com as demais substâncias, será essencial para hidratá-la.
Essa concentração é importante porque ela torna a solução isotônica, isto é, seus sais minerais apresentam a mesma concentração ou concentração semelhante à concentração dos sais nos líquidos ou fluidos do corpo humano, como o suor, por exemplo.
É importante tomar bebidas assim, pois elas são absorvidas de forma mais fácil e rápida pelo organismo.
Entretanto, se houver a ingestão de soluções com concentração muito superior às de nosso organismo, isto é, soluções hipertônicas, problemas podem surgir; as células de nosso corpo perderão água, desidratando-se.
O contrário também traz danos ao organismo. A ingestão de soluções hipotônicas – com concentração muito inferior a do organismo – faz com que as células inchem até explodirem.
b) Osmose.
As propriedades coligativas explicam uma série de fenômenos que observamos no cotidiano. A respeito desse assunto, julgue os itens:
a) Quando colocamos gelo dentro de um copo e o colocamos sobre a mesa, num dia quente de verão, a água que aparece na superfície externa do copo deve-se ao fenômeno conhecido como osmose.
b) Ao dissolvermos, em água do mar, um pouco de açúcar, a pressão de vapor da água diminui.
c) A adição de aditivos na água de refrigeração torna possível a diminuição da temperatura dos sistemas.
d) Em certas regiões do interior é comum salgar pedaços de carne, pois em presença do sal, por osmose, a água atravessa a membrana celular, desidratando o alimento.
e) Ao nível do mar, os sucos congelam a uma temperatura inferior a 0ºC.
f) Os alimentos cozinham mais rapidamente na panela de pressão, pois a temperatura de ebulição da água no seu interior é maior.
g) Ao nível do mar, se você aquecer um recipiente contendo café preparado, o líquido entrará em ebulição a uma temperatura superior a 100ºC.
a) Falso. Nesse caso, não é a osmose que ocorre. Na verdade o vapor de água presente no ar se condensa ao entrar em contato com as paredes frias do copo.
b) Verdadeiro.
c) Verdadeiro.
d) Verdadeiro.
e) Verdadeiro.
f) Verdadeiro.
g) Verdadeiro.
Um aluno viu num noticiário que nos países frios como Estados Unidos, Canadá e países europeus, a prática de adicionar aditivos especiais a radiadores de automóveis é bastante comum, pois esses aditivos alteram algumas propriedades físicas da água. Que alterações podem ocorrer com as propriedades físicas da água?
Ocorre elevação da temperatura de ebulição e diminuição da temperatura de congelamento. Em países frios, essa prática é interessante porque evita que a água dos radiadores congele no inverno.
(UCDB-MT) As propriedades coligativas das soluções dependem:
a) Da pressão máxima de vapor do líquido.
b) Da natureza das partículas dispersas na solução.
c) Da natureza do solvente, somente.
d) Do número de partículas dispersas na solução.
e) Da temperatura de ebulição do líquido.
Alternativa “d”.
(FCMSC-SP) Considere o gráfico da pressão máxima de vapor em função da temperatura para um solvente puro e para uma solução desse solvente contendo um soluto molecular não volátil.
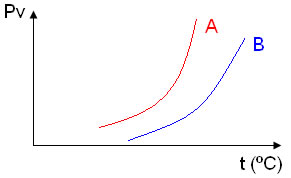
A seu respeito podemos afirmar:
a) A curva A representa a solução.
b) A curva A representa o solvente.
c) A curva B representa o solvente.
d) A solução apresenta pressão máxima de vapor maior que o solvente.
e) Ambas as curvas, numa mesma temperatura, apresentam mesma pressão máxima de vapor.
Alternativa “b”. A curva A representa o solvente porque ela apresenta maior pressão de vapor e a pressão de vapor de um solvente puro sempre é maior que a desse solvente numa solução.
(VUNESP/96 – Conhec. Gerais) Comparando-se os pontos de congelação de três soluções aquosas diluídas de KNO3, MgSO4 e Cr(NO3)3, de mesma concentração em mol/L, verifica-se que:
a) as três soluções têm o mesmo ponto de congelação.
b) os pontos de congelação decrescem na seguinte ordem:
KNO3 < MgSO4 < Cr(NO3)3.
c) a solução de Cr(NO3)3 tem ponto de congelação mais baixo que as soluções dos outros dois sais.
d) o ponto de congelação de cada solução depende de seu volume.
e) as três soluções têm pontos de congelação maiores que o da água.
Alternativa “c”.
Quanto maior a concentração de partículas, menor o ponto de congelação ou solidificação. Considerando α = 100% para todos os casos, temos:
1 KNO3(s) → 1 K+(aq) + 1 NO3-(aq)
0,1 mol 0,1 mol 0,1 mol
Total = 0,2 mol de partículas em solução.
1 MgSO4(s) → 1 Mg2+(aq) + 1 SO4-(aq)
0,1 mol 0,1 mol 0,1 mol
Total = 0,2 mol de partículas em solução.
1 Cr(NO3)3(s) → 1 Cr3+(aq) + 3 NO3-(aq)
0,1 mol 0,1 mol 0,3 mol
Total = 0,4 mol de partículas em solução.
A solução de Cr(NO3)3 tem ponto de congelaçãomais baixo que as soluções dos outros dois sais.






