Exercícios sobre propriedades dos compostos orgânicos
(UFMG) Considere as substâncias:
CH3(CH2)3CH3 CH3(CH2)3CH2OH
I II
CH3CH2CH3 CH3CH2OCH2CH2CH3
III IV
A alternativa que apresenta as substâncias em ordem crescente de temperatura de ebulição é:
a) I, III, II, IV.
b) III, I, II, IV.
c) I, III, IV, II.
d) III, I , IV, II.
Alternativa “d”.
* O composto III é o que possui menor ponto de ebulição porque ele é um alcano de cadeia normal, sendo, portanto, apolar, e os compostos orgânicos apolares possuem uma atração menor entre suas moléculas do que as que ocorrem no caso dos polares;
* O composto I também é apolar, porém, a sua cadeia é maior, tendo uma massa molecular maior e, por isso, seu ponto de ebulição é um pouco maior que o do III;
* O composto IV é o próximo porque sua molécula possui o oxigênio como heteroátomo, o que o torna polar;
* O composto que tem maior ponto de ebulição é o II, porque ele é apolar e possui o grupo OH que realiza ligações de hidrogênio entre suas moléculas. Esse é o tipo de força intermolecular mais intenso e, com isso, é mais difícil de ser rompido, precisando absorver mais quantidade de energia, ou seja, seu ponto de ebulição é o maior.
(PUC-SP) Sobre os compostos butano, 1-butanol e ácido butanoico, foram feitas as seguintes afirmações:
Suas fórmulas moleculares são respectivamente C4H10, C4H10O e C4H8O2.
(II) A solubilidade em água do butano é maior do que a do 1-butanol.
(III) O ponto de ebulição do ácido butanoico é maior do que o do 1-butanol.
(IV) O ponto de fusão do butano é maior do que o ácido butanoico.
Estão corretas as afirmações:
a) I, III e IV.
b) II e IV.
c) I e III.
d) III e IV.
e) I e II.
Alternativa “c”.
Correta.
Butano: CH3 ─ CH2 ─ CH2 ─ CH3 → C4H10.
1-butanol: CH3 ─ CH2 ─ CH2 ─ CH2 ─ OH → C4H10O.
Ácido butanoico: O
║
CH3 ─ CH2 ─ CH2 ─ C ─ OH → C4H8O2.
Incorreta. A solubilidade em água do 1-butanol é maior do que a do butano porque o 1-butanol é um álcool, ou seja, possui o grupo hidroxila (OH) que realiza ligações de hidrogênio com as moléculas de água. Já o butano é apolar e não se solubiliza na água, que é polar.
Correta. O ponto de ebulição do ácido butanoico é maior do que o do 1-butanol porque o ácido, além do grupo OH, contém também mais um oxigênio, por isso ele forma ligações de hidrogênio duplas entre suas moléculas, tendo uma interação intermolecular maior e, consequentemente, o seu ponto de ebulição também é maior
(IV) Incorreta. O ponto de fusão do butano é menor do que o ácido butanoico pelo mesmo motivo citado no item III.
Abaixo temos dois compostos isômeros, o butano e o metilpropano, com as suas respectivas temperaturas de fusão e ebulição:
CH3 ─ CH2 ─ CH2 ─ CH3 CH3 ─ CH ─ CH3
│
CH3
Ponto de fusão: -138 ºC; Ponto de fusão: -159 ºC
Ponto de ebulição: - 0,5 ºC; Ponto de ebulição: -12ºC.
Apesar de possuírem a mesma fórmula molecular (C4H10), os pontos de fusão e ebulição são diferentes. Essa propriedade aumentou no caso do butano, pois:
a) Possui massa molar maior.
b) Possui menos grupos metila (CH3).
c) A sua cadeia principal é maior.
d) Possui maiores interações de ligações de hidrogênio.
e) Sua cadeia é normal, sem ramificações.
Alternativa “e”.
Comparando dois isômeros quaisquer, o que possuir cadeia normal ou for menos ramificado apresentará pontos de fusão e de ebulição maiores que o de cadeia mais ramificada. Isso acontece porque as moléculas de cadeia normal possuem maior área superficial, tendo as forças de dipolo induzido mais intensas, necessitando de maior quantidade de energia (maiores pontos de fusão e de ebulição) para serem rompidas.
Dentre as substâncias abaixo, qual é mais solúvel em água?
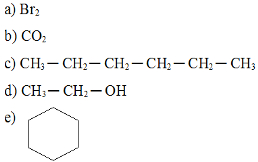
Exercício sobre solubilidade dos compostos orgânicos
Alternativa “d”.
Todos os compostos apresentados, com exceção do etanol na alternativa “d”, são apolares e não se solubilizam em água, que é polar. O etanol possui a extremidade polar e o grupo OH realiza ligações de hidrogênio com as moléculas de água.






